A démontré une diminution du score de pire douleur dans l’ensemble comparativement au placebo lors d’une biopsie de la moelle osseuse chez les adultes
Chez des patients subissant une biopsie de la moelle osseuse, le score moyen de pire douleur était significativement plus bas avec PENTHROX® (n=49) qu’avec le placebo (n=48) (score à l’ÉÉN de 4,9, comparé à 6,0; p=0,011)1**.
Le principal paramètre d’évaluation était la pire douleur ressentie pendant l’intervention, qui correspondait au plus élevé de deux scores d’intensité de la douleur [échelle d’évaluation numérique (ÉÉN)] consignés, attribués par le patient à deux différents moments de mesure : douleurs pendant l’aspiration et douleurs pendant la biopsie au trocart. À l’aide de l’ÉÉN, on a demandé aux patients d’attribuer un score à l’intensité de la pire douleur ressentie pendant l’aspiration, pendant la biopsie au trocart et à la fin de l’intervention (de façon globale).

Score de douleur moyen pendant l’intervention
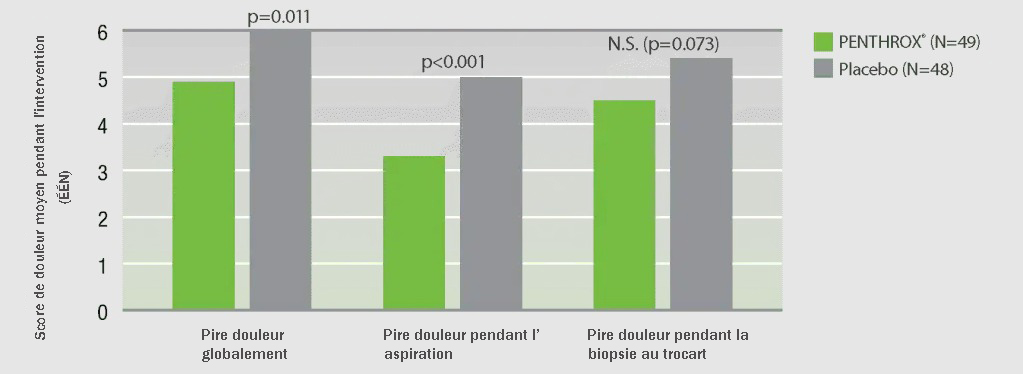
** Étude de phase IV multicentrique, à double insu, à répartition aléatoire et contrôlée par placebo visant à évaluer le profil d’efficacité et d’innocuité de PENTHROX® dans le soulagement des douleurs incidentes chez les patients adultes requérant une analgésie lors d’une biopsie de la moelle osseuse (PENTHROX® 49, placebo 48).
ÉÉN = échelle d’évaluation numérique; ÉVA = échelle visuelle analogique; ITT = population en intention de traiter
Innocuité et tolérabilité établies démontrées lors d'essais cliniques
Les effets indésirables les plus fréquents (> 5 %)1 :
- au suivi à 48 heures dans le groupe PENTHROX® ont été la douleur au site de la biopsie de la moelle osseuse, les nausées et la somnolence (altération du niveau de conscience);
- au suivi à 30 jours ont été la fatigue (asthénie, léthargie, malaise), la douleur, la constipation et les nausées dans les deux groupes.
Effets indésirables survenus en cours de traitement chez ≥ 2 % des patients après une biopsie de la moelle osseuse (de 30 à 45 minutes après l’intervention)
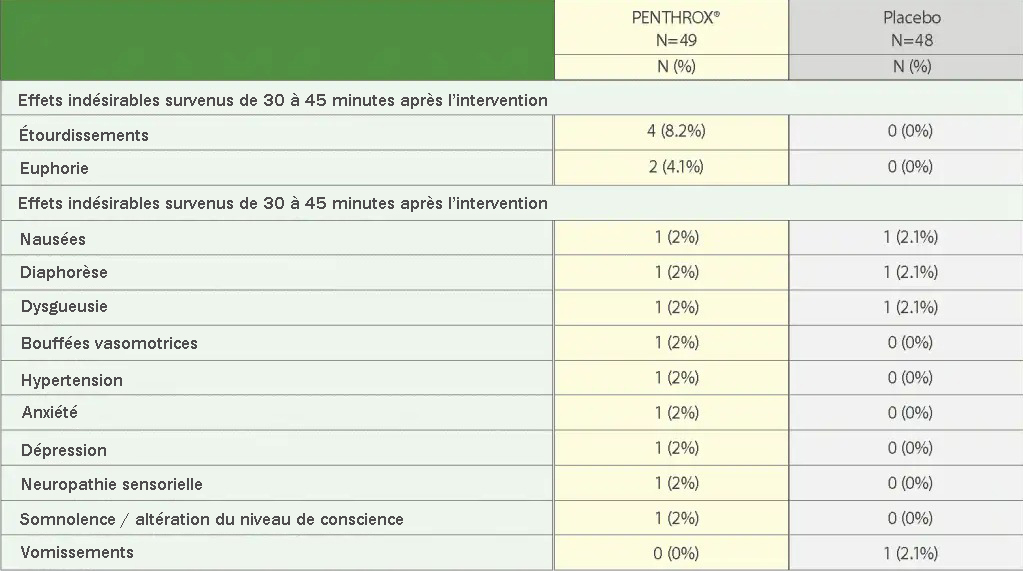
D’après la monographie de PENTHROX®.
n = nombre d’événements, N = nombre de patients, % = pourcentage de patients.
Utilisation clinique :
Étant donné les restrictions liées à la dose de PENTHROX® et la durée du soulagement de la douleur obtenu pendant un traitement, PENTHROX® ne convient pas pour le soulagement des accès douloureux liés à des états de douleur chronique. PENTHROX® ne convient pas non plus pour le soulagement des douleurs répétitives. PENTHROX® n’est pas indiqué pendant la grossesse ni pendant la période de péripartum, y compris le travail.
Contre-indications :
- Une altération de l’état de conscience, quelle qu’en soit la cause, notamment une blessure à la tête ou la consommation de drogues ou d’alcool
- Une insuffisance rénale d’importance clinique
- Des antécédents de dysfonction hépatique après avoir reçu du méthoxyflurane ou d’autres anesthésiques halogénés
- Une hypersensibilité au méthoxyflurane ou à d’autres anesthésiques halogénés
- Une prédisposition connue ou génétique à l’hyperthermie maligne ou des antécédents personnels ou familiaux (proche parent) de réactions indésirables graves
- Une instabilité hémodynamique manifeste sur le plan clinique
- Des difficultés respiratoires manifestes sur le plan clinique
- Une utilisation comme agent anesthésique
Mises en garde et précautions les plus importantes :
Néphrotoxicité : Des doses suprathérapeutiques de méthoxyflurane en inhalation ont causé une néphrotoxicité irréversible grave, liée à la dose. Il faut respecter rigoureusement la limite posologique afin de prévenir ou de réduire le risque de néphrotoxicité. L’utilisation de PENTHROX® deux jours consécutifs n’est pas recommandée en raison du risque d’effets néphrotoxiques. La plus faible dose efficace de PENTHROX® doit être administrée, en particulier chez les personnes âgées ou les patients présentant d’autres facteurs de risque connus de néphropathie.
Hépatotoxicité : Le méthoxyflurane en inhalation a été associé à de très rares cas d’hépatotoxicité lorsqu’il a été utilisé aux fins d’analgésie. PENTHROX® doit être utilisé avec précaution chez les patients présentant une affection hépatique sous-jacente ou des facteurs de risque de dysfonction hépatique. PENTHROX® ne doit pas être utilisé chez les patients ayant déjà montré des signes de lésions hépatiques après un usage antérieur de méthoxyflurane ou d’un anesthésique à base d’hydrocarbure halogéné.
Autres mises en garde et précautions pertinentes :
- Effets potentiels sur le SNC
- Administrer avec prudence chez les personnes âgées atteintes d’hypotension ou de bradycardie, en raison d’une baisse de tension artérielle possible
- Dépendance au médicament
- Peut influencer la capacité à conduire un véhicule et à utiliser des machines
- Ne pas administrer en concomitance avec de l’alcool
- Afin de réduire l’exposition professionnelle au méthoxyflurane, l’inhalateur PENTHROX® doit toujours être utilisé avec une cartouche de charbon activé qui adsorbe le méthoxyflurane expiré.
- Réactions cutanées locales ou irritation aux yeux et aux membranes muqueuses
- La prudence est de mise en cas d’administration à une femme qui allaite
Pour de plus amples renseignements :
Veuillez consulter la monographie du produit au https://produits-sante.canada.ca/dpd-bdpp/index-fra.jsp pour des renseignements importants au sujet des réactions indésirables, des interactions médicamenteuses, des conseils à donner au patient, ainsi que de la posologie/mise au rebut (en ce qui a trait à la dose maximale totale pour une seule administration ou pendant la première journée de traitement, par période de 48 heures et pendant toute la durée du traitement) qui n’ont pas été abordés ici.
On peut aussi obtenir la monographie en appelant au 1-888-867-7426.
† Portée clinique comparative inconnue.
* Portée clinique inconnue.
Références :
- PENTHROX® Monographie du produit, Paladin Pharma inc., avril 2022.
- Borobia AM, Collado SG, Cardona CC, et al. Inhaled Methoxyflurane Provides Greater Analgesia and Faster Onset of Action Versus Standard Analgesia in Patients With Trauma Pain: InMEDIATE: A Randomized Controlled Trial in Emergency Departments. Annals of Emergency Medicine. 2020;75(3):315–28.
- Coffey F, Wright J, Hartshorn S, et al. STOP!: a randomised, double-blind, placebo-controlled study of the efficacy and safety of methoxyflurane for the treatment of acute pain. Emerg Med J. 2014;31(8):613–8.
- Voza A, Ruggiano G, Serra S, et al. Inhaled Methoxyflurane versus Intravenous Morphine for Severe Trauma Pain in the Emergency Setting: Subgroup Analysis of MEDITA, a Multicenter, Randomized, Controlled, Open-Label Trial. JPR. 2020;Volume 13:491–502.
- Spruyt O, Westerman D, Milner A, et al. A randomised, double-blind, placebo-controlled study to assess the safety and efficacy of methoxyflurane for procedural pain of a bone marrow biopsy. BMJ Support Palliat Care. 2014;4(4):342–8.
- Grummet J, Huang S, Konstantatos A, et al. The ‘green whistle’: A novel method of analgesia for transrectal prostate biopsy: NOVEL METHOD OF ANALGESIA FOR TRUS-GUIDED PROSTATE BIOPSY. BJU Int. 2012;110:85–8.
- Nguyen NQ, Toscano L, Lawrence M, et al. Patient-controlled analgesia with inhaled methoxyflurane versus conventional endoscopist-provided sedation for colonoscopy: a randomized multicenter trial. Gastrointestinal Endoscopy. 2013;78(6):892–901.
-
Brichko L, Gaddam R, Roman C, et al. Rapid Administration of Methoxyflurane to Patients in the Emergency Department (RAMPED) Study: A Randomized Controlled Trial of Methoxyflurane Versus Standard Care. Miner J, editor. Acad Emerg Med. 2021;28(2):164–71.



